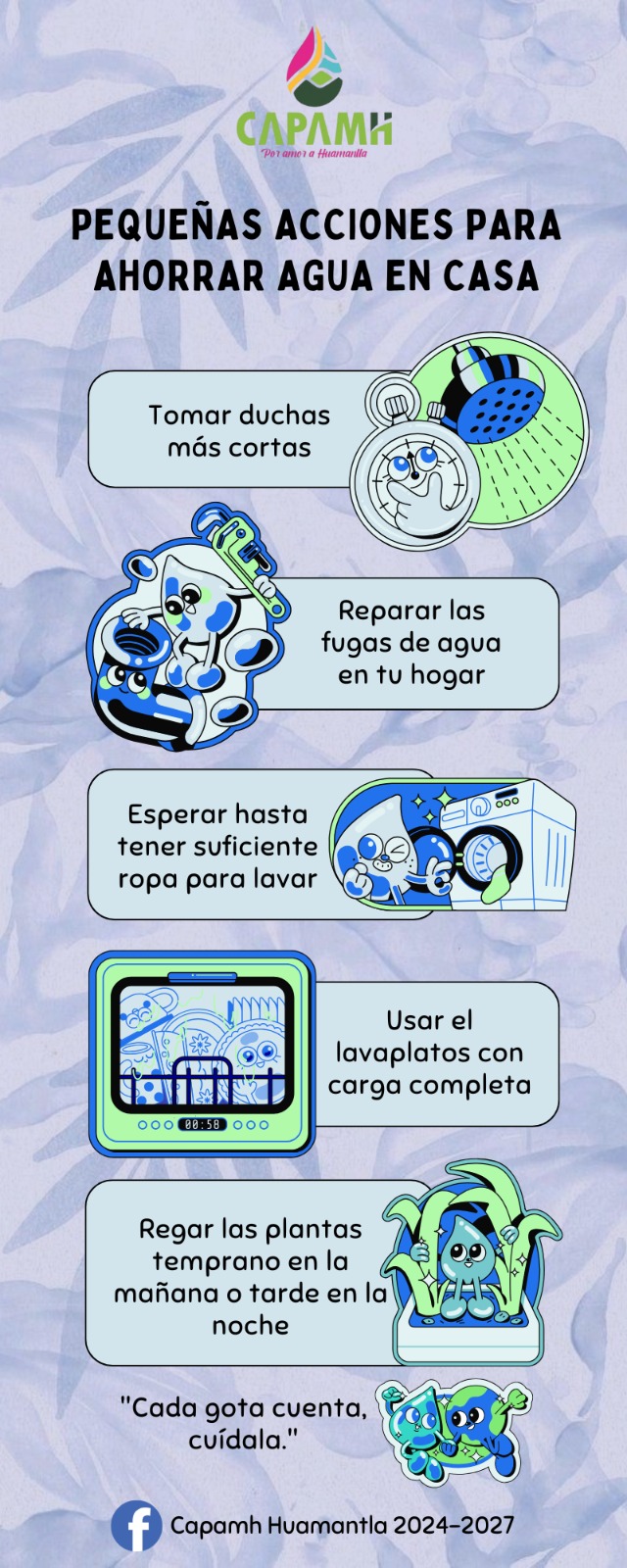
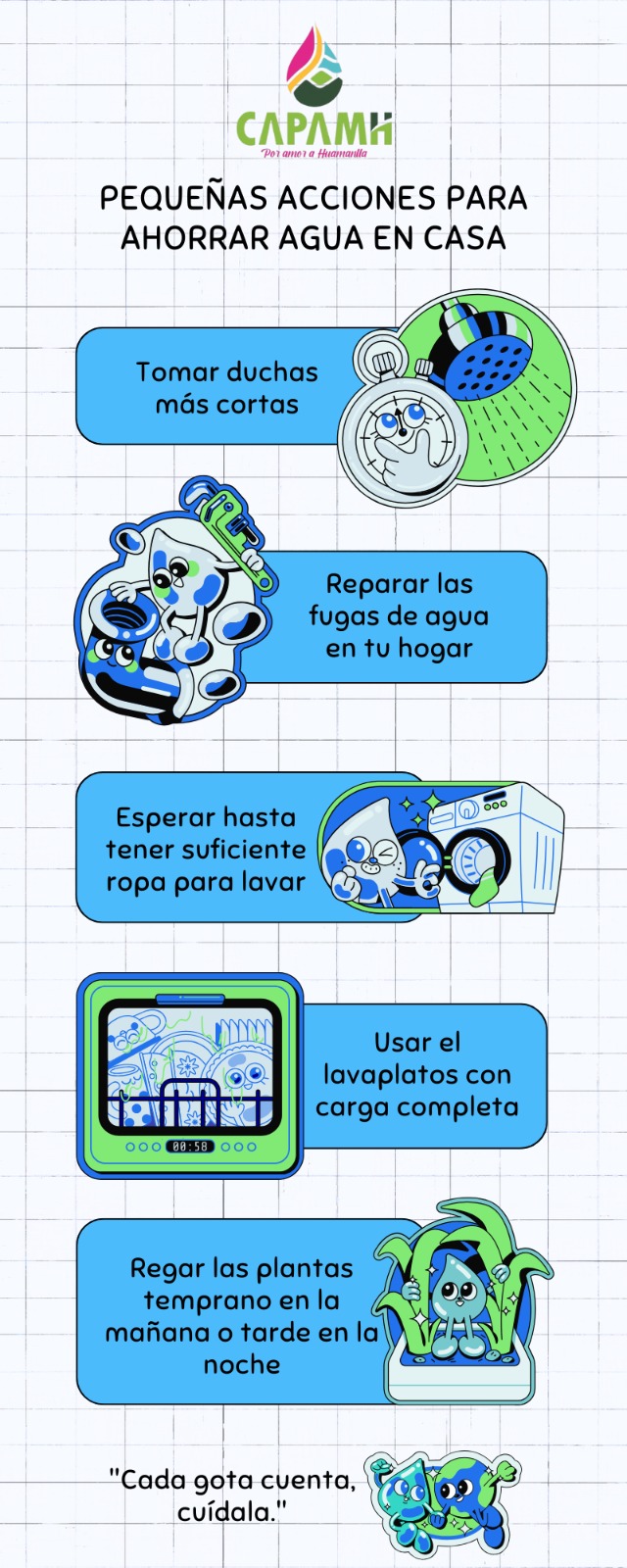
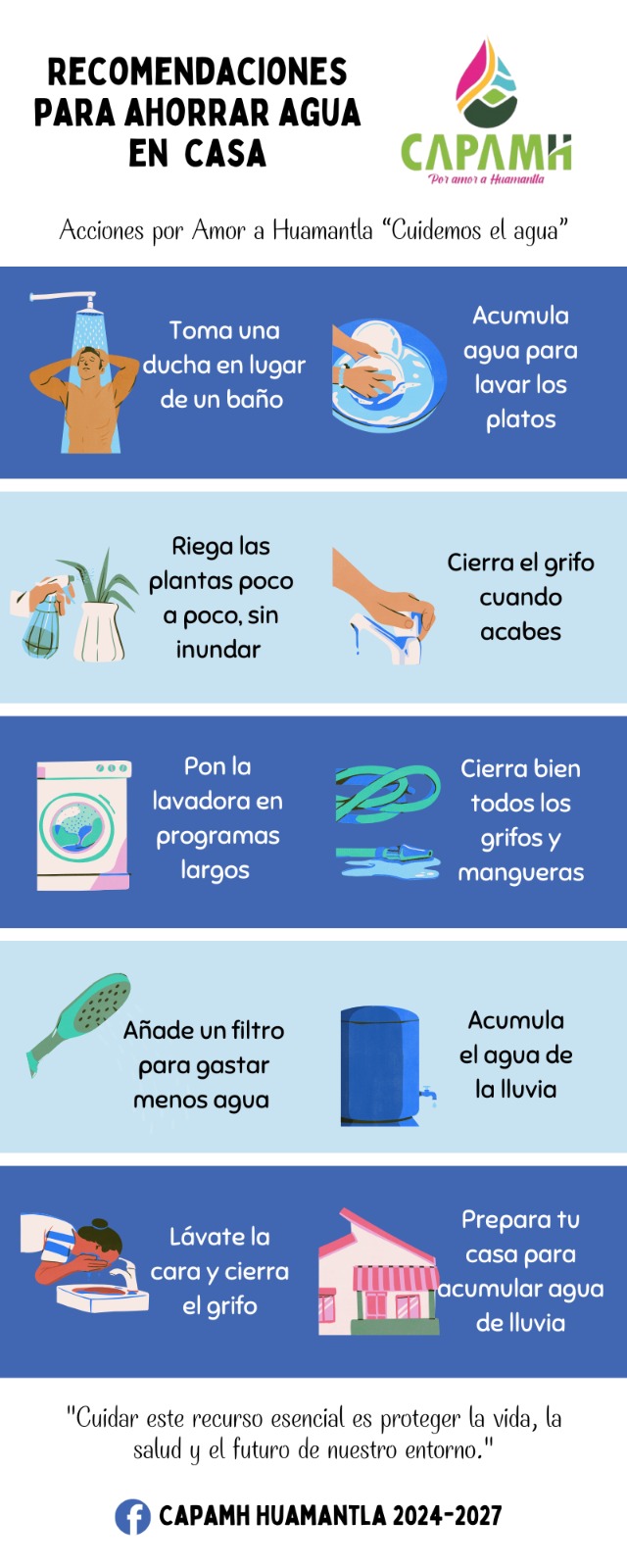
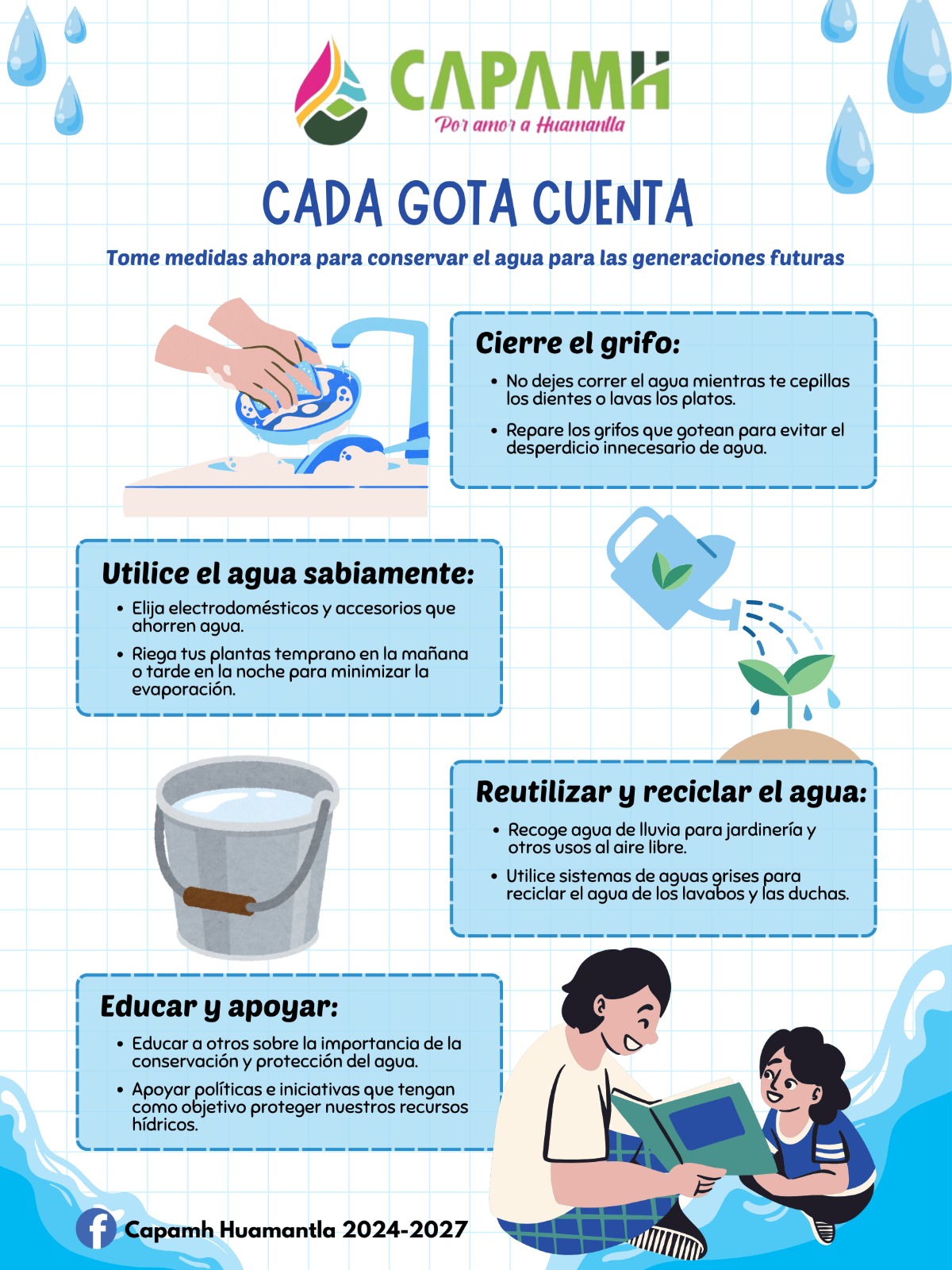
¿La solución a la epidemia de obesidad se encuentra en nuestros cerebros? Un estudio realizado por investigadores de la Universidad Rockefeller, en Nueva York, EU, sugiere que es posible.
“Hemos identificado dos nuevas poblaciones de células en el cerebro que regulan potentemente el apetito“, indicó Alexander Nectow, primer autor del estudio, publicado esta semana en la revista Cell. Los dos tipos de células, ubicadas en una parte del tronco encefálico llamada núcleo dorsal del rafe, actúan como blancos potenciales para desarrollar nuevos medicamentos contra la obesidad, pues controlan las señales del hambre que conducen la búsqueda y el consumo de alimento.
Los nuevos hallazgos son la última evidencia de que comer es un comportamiento biológico complejo mediado por múltiples sitios en el cerebro. También ofrecen una posible solución a un problema que ha mermado esfuerzos previos para abordar la obesidad a nivel neuronal.
“La obesidad se asocia generalmente con la resistencia a la leptina“, dijo Jeffrey Friedman, descubridor de la citada hormona —la cual actúa sobre las neuronas en la región del hipotálamo para suprimir el hambre— y cuyo laboratorio produjo el nuevo estudio. “Y nuestros datos recientes sugieren que la modulación de la actividad de neuronas específicas con fármacos podría pasar por alto la resistencia a la leptina y proporcionar un nuevo medio para reducir el peso corporal“.
Para concretar el trabajo, Nectow y sus colegas se centraron en el núcleo dorsal del rafe (o NDR), tomando imágenes de cerebro entero mediante el método iDISCO —una técnica avanzada desarrollada en Rockefeller—. Con ello, revelaron que esta parte del cerebro se activaba en ratones hambrientos. Las imágenes subsecuentes de otros ratones que comieron una cantidad mayor a la normal de alimento, hasta que se sintieron llenos, mostró un patrón distinto en la actividad del NDR. Estos resultados indicaron claramente que las neuronas en esa región cerebral jugaron un papel clave en el comportamiento alimentario.
El siguiente paso fue determinar cuáles de los varios tipos de neuronas que componen al NDR estaban involucrados. El análisis genético de las células activadas en los dos grupos de ratones mostró que las neuronas se activaron gracias a la liberación de glutamato —un químico que usan las células nerviosas para enviar señales entre ellas— causada por saciedad, mientras que las neuronas activadas por el hambre liberaron un neurotransmisor diferente, conocido como GABA.
Armados con dos métodos eficaces para activar las neuronas objetivo a voluntad —uno óptico y uno químico— los investigadores fueron capaces de activar las células liberadoras de glutamato en ratones con obesidad. Esto suprimió la ingesta de alimentos de los animales y les hizo perder peso. De esta forma, confirmaron que las neuronas en el NDR activadas por el hambre de hecho impulsaron la ingesta de alimentos.
Asimismo, se dieron cuenta de que las neuronas liberadoras de GABA en la misma parte del cerebro causaban el efecto opuesto y aumentaban la ingesta de alimentos. En particular, activar las “neuronas del hambre” automáticamente desactivó las “neuronas de saciedad”, maximizando el efecto.
Los investigadores también estudiaron el efecto de apagar las neuronas del hambre en ratones obesos, observando que la inhibición prolongada de las mismas podía reducir drásticamente el peso corporal.
Los descubrimientos abren nuevas vías de investigación sobre cómo el cerebro controla la alimentación, y sugieren que diseñar fármacos que activen o inhiban las neuronas en el NDR podría ser eficaces en el tratamiento de la obesidad y para prevenir sus trastornos relacionados, como la diabetes y la hipertensión.
Vía: EurekAlert! – American Association for the Advancement of Science
Imagen: Michigan Medicine